Biomaterials(《生物材料》)近日发表hg1088皇冠welcome全红研究团队与暨南大学第二临床医学院合作成果。该成果提出超小半胱胺包覆FePd-Cys双金属纳米点的方法,对于提升肿瘤放疗效果具有重要意义。
论文题为“Bimetallic Nanodots for Tri-modal CT/MRI/PA Imaging and Hypoxia-Resistant Thermoradiotherapy in the NIR-II Biological Windows”(《用于CT/MRI/PA三模态成像以及改善肿瘤乏氧的热放疗(近红外二区)双金属纳米点》),hg1088皇冠welcome博士生吕梦为第一作者,全红老师和暨南大学的李阳老师为共同通讯作者。hg1088皇冠welcome为论文第一署名单位。
放疗(RT)是一种常见的治疗肿瘤的手段,肿瘤微环境缺氧是导致放疗的耐药或失败的一个重要原因。光热治疗(PTT)作为一种非侵入性治疗方法,除了直接杀死肿瘤细胞外,还可以改善肿瘤缺氧微环境。目前,PTT联合RT(热放疗)正成为一种新兴的治疗方法。而这种方法所需要的耐缺氧型热疗的多功能纳米颗粒的缺乏正制约着这项技术的治疗效果。
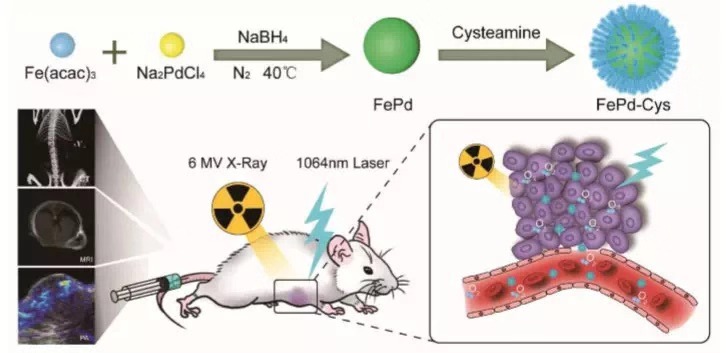
图1 FePd-Cys纳米点的合成流程及其用于肿瘤治疗和成像示意图
为了解决以上问题,研究者设计了一种能简便合成在第二近红外(NIR-II)生物窗(1000~1700μnm)起作用的超小半胱胺(Cys)包覆FePd双金属纳米点(NDs)。实验测试表明,这些NDs产生了高达35.4%的热疗,同时因为其光热转化效应使肿瘤组织中的缺氧得到了改善,并且材料本身能在肿瘤细胞中沉积辐射能量,这些作用大大增强了肿瘤细胞对放疗的敏感性。与此同时NDs还能作为体外和体内三模态成像的造影剂,包括计算机断层扫描(CT)、磁共振成像(MRI),以及光声成像(PAI)。这种材料的出现将大大加强光热治疗联合热放疗疗法的疗效,有非常重要的科研及临床价值。
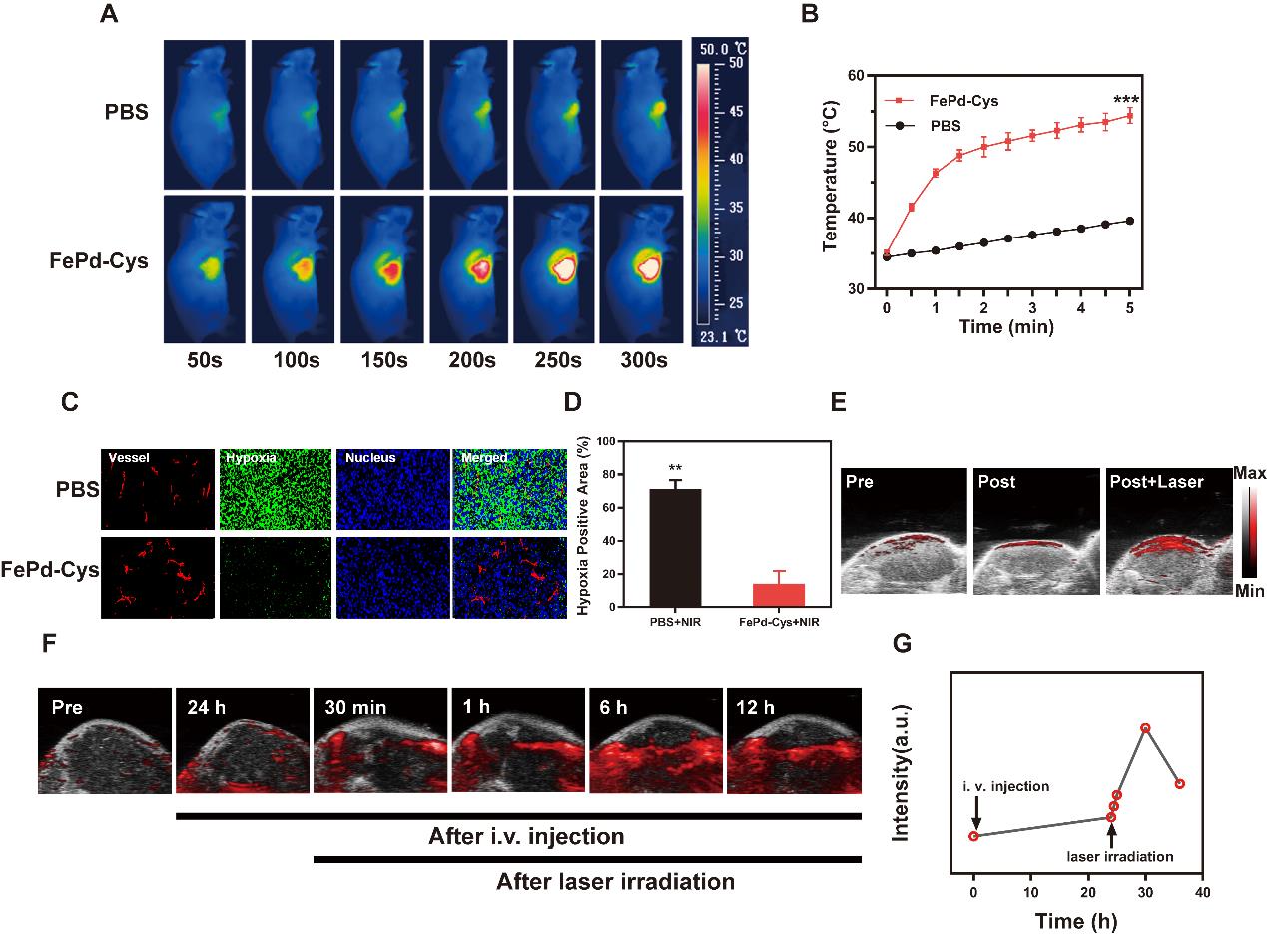
图2(A)FePd-Cys纳米点的体内实时光热效果热像图及(B)升温曲线;(C)肿瘤组织切片的免疫荧光染色;(D)荧光强度图;(E)尾静脉注射FePd-Cys纳米点前,注射药物24h后及近红外光照射30min后体内肿瘤血氧含量分布;(F)注射药物前,注射药物24h后,近红外光照射30min,1h,6h,12h后体内肿瘤血氧含量分布以及(G)随时间变化的血氧含量图。
原文链接:https://doi.org/10.1016/j.biomaterials.2019.119656